Hóa chất công nghiệp Acid Sulfuric, ứng dụng và cách sử dụng
Acid sulfuric là một hóa chất công nghiệp hàng hóa rất quan trọng, khả năng sản xuất acid sulfuric của một quốc gia được coi là một chỉ số về sức mạnh công nghiệp của quốc gia đó trong thế kỷ 20.
Giới thiệu
Acid Sulfuric, còn được gọi là vitriol, là một acid khoáng gồm các nguyên tố lưu huỳnh, oxygen và hydrogen, với công thức phân tử H2SO4. Nó là một chất lỏng không màu, không mùi, và hỗn hợp hòa tan trong nước, trong một phản ứng tỏa nhiệt cao.

Trong môi trường, acid sulfuric là một thành phần của mưa axit, vì nó được hình thành bởi quá trình oxy hóa khí quyển của sulfur dioxide trong sự hiện diện của nước. Khí sulfur dioxide trong khí quyển được tạo ra bằng cách đốt các nhiên liệu hóa thạch có chứa lưu huỳnh như than và dầu.
Lịch sử ghi nhận việc phát hiện ra acid sulfuric được ghi nhận cho nhà giả kim thuật thế kỷ thứ 8 là Jabir ibn Hayyan. Sau đó tiếp tục được nghiên cứu bởi bác sĩ và nhà giả kim thuật thế kỷ thứ 9 Ibn Zakariya al-Razi (Rhases), người đã thu được acid sulfuric bằng cách chưng cất khoáng chất khô bao gồm sắt (II) sulfat heptahydrat, FeSO4.7H2O, và đồng (II) sulfat pentahydrat, CuSO45H2O. Khi nung nóng, các hợp chất này phân hủy thành oxit sắt (II) và ôxít đồng (II), tương ứng, tạo ra nước và lưu huỳnh trioxide, kết hợp để tạo ra dung dịch loãng acid sulfuric. Phương pháp này đã được phổ biến rộng rãi ở châu Âu thông qua các bản dịch các sách và sách giáo khoa tiếng Ả Rập và Ba Tư của các nhà giả kim thuật châu Âu, như Albertus Magnus, thế kỷ 13 của Đức.
Acid sulfuric được các nhà giả kim thuật thời Trung cổ Châu Âu biết đến như là dầu của vitriol, linh hồn của vitriol hoặc đơn giản là vitriol, cùng với các tên khác. Từ vitriol có nguồn gốc từ thủy tinh Latin, ‘thủy tinh’ cho sự xuất hiện thủy tinh của các muối sulfat, cũng mang tên vitriol. Muối được gọi bằng tên này bao gồm đồng (II) sulfat (vitriol xanh, hoặc hiếm khi vitriol La Mã), kẽm sulfat (vitriol trắng), sắt (II) sulfat (vitriol xanh), sắt (III) sulfat (vitriol của Sao Hỏa), và coban (II) sulfat (vitriol đỏ).
Vitriol được coi là chất hóa học quan trọng nhất trong lịch sử bởi tính ứng dụng cao, được sử dụng làm đá của nhà triết học. Vitriol tinh khiết cao được sử dụng như một chất trung gian để phản ứng. Điều này phần lớn là do acid không phản ứng với vàng, thường là mục tiêu cuối cùng của các quá trình hóa trị.
Vào thế kỷ 17, nhà hóa học người Đức – Hà Lan, Johann Glauber đã tạo ra acid sulfuric bằng cách đốt lưu huỳnh cùng với nitrat (kali nitrat – KNO3), khi có hơi nước. Khi phân tử muối phân hủy sẽ oxy hóa lưu huỳnh thành SO3, kết hợp với nước để tạo ra acid sulfuric. Năm 1736, Joshua Ward, một dược sĩ người London, đã sử dụng phương pháp này để bắt đầu sản xuất acid sulfuric quy mô lớn đầu tiên.
Vào năm 1746 ở Birmingham, John Roebuck bắt đầu sản xuất acid sulfuric theo cách này trong các buồng lót chì, mang lại hiệu quả lớn hơn hẳn so với các quy mô và sản lượng từng sản xuất đồng thời ít tốn kém hơn. Quá trình buồng chì này cho phép công nghiệp hóa hiệu quả sản xuất acid sunfuric và với một vài cải tiến vẫn là phương pháp sản xuất tiêu chuẩn trong gần hai thế kỷ.
Axit sulfuric của John Roebuck chỉ có khoảng 35-40% acid sulfuric. Những cải tiến về sau trong quy trình buồng chì của nhà hóa học người Pháp Joseph Louis Gay Lussac và nhà hóa học người Anh John Glover đã cải thiện điều này lên 78%. Tuy nhiên, việc sản xuất một số thuốc nhuộm và các quá trình hóa học khác đòi hỏi một sản có độ đặc lớn hơn, tuy nhiên trong suốt thế kỷ 18, điều này chỉ có thể được thực hiện bằng cách chưng cất khoáng chất khô trong một kỹ thuật tương tự như các quá trình hóa học ban đầu. Pyrit (sắt disulfua, FeS2) được nung nóng trong không khí để tạo ra sắt (II) sulfat FeSO4, được oxy hóa bằng cách nung nóng hơn nữa trong không khí để tạo thành sắt (III) sulfat, Fe2(SO4)3, khi nung nóng đến 480°C phân hủy thành sắt (III) oxit và lưu huỳnh trioxide, có thể được đưa qua nước để tạo ra axít sulfuric ở bất kỳ nồng độ nào. Tuy nhiên chi phí của quá trình này lại ngăn cản việc sử dụng acid sulfuric đậm đặc.
Năm 1831, thương nhân giấm người Anh là Peregrine Phillips đã được cấp bằng sáng chế một quá trình kinh tế hơn để sản xuất sulfur trioxide và acid sulfuric đậm đặc mà hiện nay được gọi là quá trình tiếp xúc. Về cơ bản, tất cả nguồn cung cấp acid sulfuric trên thế giới hiện nay được sản xuất theo phương pháp này.
Acid sulfuric là một hóa chất hàng hóa rất quan trọng, khả năng sản xuất acid sulfuric của một quốc gia được coi là một chỉ số về sức mạnh công nghiệp của quốc gia đó trong thế kỷ 20.
Xem thêm:
Tất tần tật thông tin về hóa chất axit clohydric
Ứng dụng
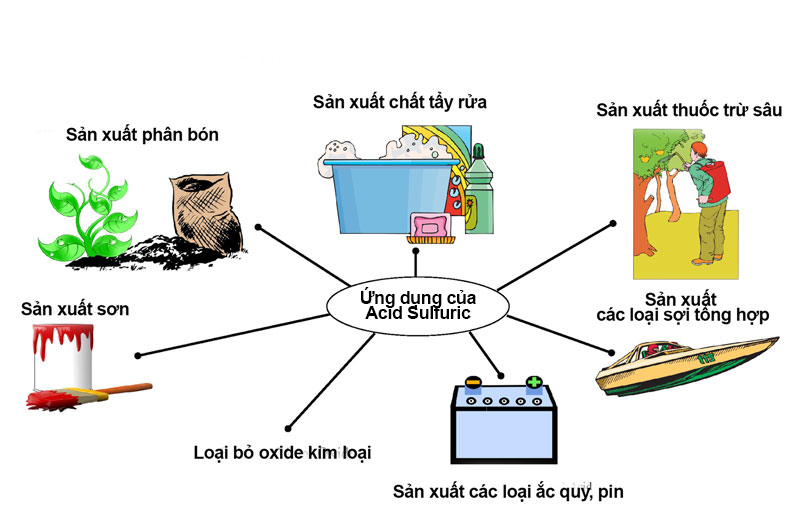
Acid sulfuric là một hóa chất công nghiệp quan trọng được sử dụng trong quá trình sản xuất của nhiều mặt hàng trong một loạt các ứng dụng. Acid sulfuric được sử dụng trong ngành công nghiệp giấy và bột giấy để tạo ra dioxide chlorine, tách dầu cao và điều chỉnh pH. Hơn một triệu tấn acid sulfuric được sản xuất mỗi năm chỉ riêng tại Anh, với hơn 40 triệu tấn được sản xuất tại Mỹ. Sản xuất acid sulfuric hàng năm trên toàn thế giới là khoảng 180 triệu tấn.
Dưới đây là danh sách các ứng dụng sử dụng acid sulfuric với số lượng ngày càng tăng:
- Hóa chất nông nghiệp.
- Sản xuất Nhôm Sulfat.
- Pin.
- Giấy bóng kính.
- Chất tẩy rửa.
- Chất nổ.
- Phân Bón.
- Xăng.
- Thuốc diệt cỏ.
- Sắt và thép.
- Nhiên liệu máy bay phản lực.
- Kerosene.
- Da.
- Dầu bôi trơn.
- Các quá trình sản xuất thuốc.
- Phụ gia dầu.
- Giấy.
- Rayon và cao su.
- Đường.
- Sợi tổng hợp.
- Thuốc thú y.
- Làm mềm nước, xử lý nước.
- Sắc tố màu vàng.
Xem thêm:
6 vai trò quan trọng của ngành công nghiệp hóa chất
Sản xuất hóa chất: Là chất hóa học có phạm vi ứng dụng rộng, acid sulfuric được sử dụng trong các quá trình sản xuất các hóa chất khác bao gồm acid chlohydric, acid nitric, acid phosphoric và nhiều loại hóa chất công nghiệp khác.
Lọc dầu: Quá trình tinh chế dầu thô đòi hỏi việc sử dụng acid làm chất xúc tác và acid sulfuric thường được sử dụng cho mục đích này trong một đơn vị Alkylation acid SAAU hoặc sulfuric.
Chế biến kim loại: “Tuyển quặng” là thuật ngữ chỉ quá trình xử lý kim loại để loại bỏ các tạp chất, gỉ sét hoặc xử lý bề mặt chẳng hạn như trong chế tạo thép. Ngày nay, việc sử dụng acid sulfuric cho mục đích này đã giảm một chút vì ngành công nghiệp hiện nay ủng hộ việc sử dụng acid chlohydric. Mặc dù acid hydrochloric đắt hơn acid sulfuric nhưng tạo ra kết quả nhanh và có tính chọn lọc hơn và giảm thiểu sự mất mát của kim loại cơ bản trong quá trình tẩy rửa.
Sản xuất Rayon dệt: Rayon được làm từ sợi cellulose có nguồn gốc từ gỗ. Chúng được hòa tan trong dung dịch Tetra Amine Copper (II) để tạo ra chất lỏng màu xanh đậm, sau đó được bơm vào acid sulfuric để tạo thành sợi Rayon. Rayon được coi là một loại vải bán tổng hợp tốt và có thể cạnh tranh với lụa để treo lên và óng ánh, đôi khi nó được gọi là ‘lụa nghệ thuật’ bởi khả năng dễ dàng nhuộm và vải mềm, mát và mịn. Tuy nhiên, không giống như tơ tằm, Rayon không cách nhiệt cơ thể nên hoàn hảo để sử dụng ở các có độ ẩm cao, nhiều nước và nóng.
Sản xuất pin loại chì-acid: Các loại pin loại chì-acid chì kín được sử dụng trong ngành công nghiệp ô tô. Các loại pin chì-acid hàn kín được phát minh vào năm 1859 bởi nhà máy Gaston Plants của Pháp. Acid sulfuric được sử dụng ở dạng loãng để hoạt động như một chất điện phân để cho phép dòng electron giữa các tấm trong pin. Acid sulfuric được sử dụng theo cách này thường được gọi là acid pin. Nó có thể thay đổi về hàm lượng theo nhà sản xuất pin nhưng nhìn chung là từ 28 đến 32% hoặc từ 4,2 đến 5 Mol.
Thu hoạch khoai tây: Nông dân trồng khoai tây sử dụng các hệ thống chuyên dụng để phun các cánh đồng khoai tây của họ trước khi thu hoạch để ngọn màu xanh lá cây chết lại và héo khô trong vòng một hoặc hai ngày. Điều này giúp làm khô thân cây và ngăn chúng không bị rối trong thiết bị thu hoạch. Phương pháp phun ngọn khoai tây thông thường là bằng dung dịch acid sulfuric.
Sản xuất thuốc: Các loại thuốc hóa trị được sử dụng để điều trị các loại ung thư khác nhau. Các tế bào ung thư nhạy cảm hơn với tổn thương DNA hơn so với các tế bào bình thường, vì vậy trong việc điều trị hóa trị, các tế bào ung thư bị phá hủy bằng cách làm hư hại DNA của chúng. Quá trình này được gọi là alkylation của DNA và một loại thuốc được gọi là alkylating antineoplastic được sử dụng. Acid sulfuric được sử dụng trong quá trình sản xuất các loại thuốc như vậy.
Xem thêm:
Axit clohydric 35%: đặc điểm và ứng dụng quan trọng
10 ứng dụng của axit boric trong công nghiệp
Hóa chất Acid Nitric là gì? Ứng dụng trong thực tế
Hóa chất Axit sulfuric là gì? 10 ứng dụng công nghiệp của nó
Lưu ý khi sử dụng đối với Acid Sulfuric
– Các mối nguy hiểm đến từ Acid Sulfuric:
Tiềm năng tác động đến sức khỏe: Rất nguy hiểm trong trường hợp tiếp xúc với da (ăn mòn, gây kích ứng, thẩm thấu), tiếp xúc với mắt (kích thích, ăn mòn), khi nuốt phải, hít phải. Chỉ cần ở dạng chất lỏng hoặc sương mù có thể gây tổn thương mô đặc biệt là trên màng của mắt, miệng và đường hô hấp. Tiếp xúc với da có thể gây bỏng. Hít phải dạng sương mù có thể gây kích ứng nghiêm trọng đường hô hấp gây các phản ứng ho, nghẹt thở, hoặc khó thở. Phơi nhiễm quá mức có thể dẫn đến tử vong. Viêm mắt được đặc trưng bởi mắt đỏ và ngứa. Viêm da được đặc trưng bởi ngứa, sưng tấy đỏ thỉnh thoảng phồng rộp.

Tác động ăn mòn của Acid sulfuric

Tác động lâu dài đến sức khỏe:
– Tác dụng gây ung thư: Phân loại 1 (chứng minh cho con người.) bởi IARC và OSHA; Phân loại A2 (nghi ngờ cho có thể gây ung thư cho con người.) bởi ACGIH. Chất này có thể gây độc cho thận, phổi, tim, hệ tim mạch, đường hô hấp, mắt, răng. Tiếp xúc nhiều lần hoặc kéo dài với chất này có thể gây ra tổn thương các cơ quan đích. Lặp đi lặp lại hoặc kéo dài tiếp xúc với dạng sương mù có thể gây kích ứng mắt mãn tính và kích ứng da nghiêm trọng, kích ứng đường hô hấp dẫn đến các cuộc tấn công thường xuyên của nhiễm trùng phế quản. Tiếp xúc nhiều lần với mức độ cao vật liệu độc hại có thể gây suy giảm sức khỏe nói bởi sự tích tụ trong một hoặc nhiều cơ quan của con người.
Gây cháy: Sản phẩm của quá trình đốt cháy không có sẵn vì vật liệu không cháy. Tuy nhiên, sản phẩm của decompostion bao gồm khói ocid lưu huỳnh. Sẽ phản ứng với nước hoặc hơi nước để tạo ra khói độc và ăn mòn. Phản ứng với cacbonat để tạo ra khí carbon dioxide. Phản ứng với xianua và sulfua để tạo thành xianua hydro độc và hydrogen sulfide tương ứng.
Lưu ý trong lưu trữ và bảo quản:
Phòng cháy hóa chất: Acetylua kim loại (Monocesium và Monorubidium) và cacbua đốt cháy với acid sulfuric đậm đặc. Phosphorous trắng và Acid Sulfuric hơi bốc hơi khi tiếp xúc với nhau. Có thể đốt cháy các vật liệu dễ cháy khác.
Phòng nổ: Sự trộn lẫn Acid sulfuric và bất cứ chất nào sau đây đều sẽ gây nổ: p – nitrotoluene, pentasilver trihydroxydiaminophosphate, perchlorat, rượu với hydrogen peroxide mạnh, amoni tetoxyoxychromat, nitrit thủy ngân, kali chlorat, kali permanganat với kali clorua, cacbua, hợp chất nitro, nitrat, cacbua, phospho, iodua, picratres, fulminat, dienes, rượu (khi đun nóng).
Nitramide phân hủy một cách bùng nổ khi tiếp xúc với axit sulfuric đậm đặc. 1,3,5 Trinitrosohexahydro-1,3,5-triazine + acid sulfuric gây nổ.
Xem thêm:
10 lưu ý khí sử dụng hoá chất axit sulfuric
– Sơ cứu:
Tiếp xúc với mắt: Kiểm tra và loại bỏ bất kỳ kính áp tròng nào nếu có. Trong trường hợp tiếp xúc, rửa mắt ngay lập tức với nhiều nước trong ít nhất 15 phút. Có thể sử dụng nước lạnh. Đưa đi chăm sóc y tế ngay lập tức.
Tiếp xúc với da ở mức nhé: Ngay lập tức rửa sạch da bằng nhiều nước trong ít nhất 15 phút đồng thời khi loại bỏ quần áo nhiễm bẩn và những chiếc giày. Che phủ bề mặt da mẫn ngứa với chất làm mềm da, có thể sử dụng nước lạnh. Làm sạch kỹ lưỡng acid sulfuric giày, quần áo trước khi tái sử dụng. Đưa người bị tiếp xúc đi chăm sóc y tế ngay lập tức.
Tiếp xúc với da ở mức độ nghiêm trọng: Rửa bằng xà phòng khử trùng và phủ lên da bị ô nhiễm bằng kem chống vi khuẩn. Đưa đi cấp cứu.
Hít phải: Nếu hít phải cần di chuyển tới nơi có không khí trong lành. Nếu không thở tiến hành hô hấp nhân tạo. Nếu việc thở gặp khó khăn cần sử dụng trợ giúp từ bình oxygen sau đó cần được chăm sóc y tế ngay lập tức.
Hít phải ở mức độ nghiêm trọng: Đưa nạn nhân đến một khu vực an toàn càng sớm càng tốt. Nới lỏng quần áo chặt chẽ như cổ áo, cà vạt, thắt lưng hoặc dây thắt lưng. Nếuhơi thở khó khăn cần bổ sung oxygen. Nếu nạn nhân không thở phải thực hiện quy trình hô hấp nhân tạo tuy nhiên có thể gây nguy hiểm cho người cung trực tấp thực hiện hô hấp nhân tạo khi vật liệu hít phải độc hại, tác hại có thể gây nhiễm trùng và hủy hoại các mô sống. Tìm kiếm sự chăm sóc y tế ngay lập tức.
Những chú ý khác cần được quan tâm: KHÔNG gây nôn trừ khi được nhân viên y tế yêu cầu. Không bao giờ cho bất cứ thứ gì vào miệng một người bất tỉnh. Nới lỏng quần áo chặt chẽ như cổ áo, cà vạt, thắt lưng hoặc dây thắt lưng. Cần chăm sóc y tế nếu ít nhất 1 trong triệu chứng xuất hiện.
– Biện pháp xử lý khi xảy ra sự cố tràn/rò rỉ:
Sự cố tràn nhỏ: Pha loãng bằng nước và lau hoặc hấp thụ bằng vật liệu khô trơ và đặt vào thùng chứa xử lý chất thải thích hợp. Trung hòa dư lượng bằng dung dịch natri cacbonat loãng.
Sự cố tràn lớn:
Lưu ý là chất lỏng ăn mòn, độc. Dừng rò rỉ nếu không nguy hiểm. Hấp thụ bằng đất khô, cát hoặc vật liệu không cháy khác. Không chạm vào những vật liệu đã bị đổ vỡ. Sử dụng phun nước để chuyển hướng trôi hơi và giảm hơi. Ngăn chặn lan tràn tới các khu vực khác đặc biệt là khu vực quan trọng, gọi cho lực lượng hỗ trợ xử lý nếu cần thiết.
Trung hòa dư lượng bằng dung dịch natri cacbonat loãng. Hãy cẩn thận rằng sản phẩm không có mặt ở nồng độ mức trên ngưỡng giới hạn (TLV – Threshold Limit Value). Kiểm tra giá trị TLV trên MSDS.

Trang phục bảo hộ yêu cầu: Mặt nạ, quần áo bảo hộ toàn thân, mặt nạ hơi hoặc mặt nạ ảm bảo sử dụng mặt nạ được chứng nhận hoặc tương đương, găng tay, giày ống.
Liên kết hữu ích khác:
Làm sao để lưu trữ hóa chất an toàn?
Làm thế nào để xử lý hoá chất an toàn?
Một số loại dung môi công nghiệp bạn nên biết
10 lưu ý an toàn khi sử dụng hóa chất tẩy rửa